菜单

CIDP (Centre International de Développement Pharmaceutique) 成立于 2004 年,是一家国际合同研究组织 (CRO),为制药、医疗器械、保健品和化妆品行业开展高水平的研发活动。
数据管理与生物统计
临床数据管理是临床试验中重要而关键的一步。在 CIDP,我们的解决方案是为满足您的需求而量身定制的,同时不影响质量和期限。从传统的电子表格双重数据录入,到在完整的数据管理套件中获取复杂的临床试验数据,我们可以提供广泛的服务。
我们的团队由临床数据管理员、特许统计师和数据录入操作员组成,拥有超过 16 年的广泛试验经验,能够按照 ICH E9 临床试验统计原则进行从简单的统计检验到复杂的疗效变量建模等各种统计分析。

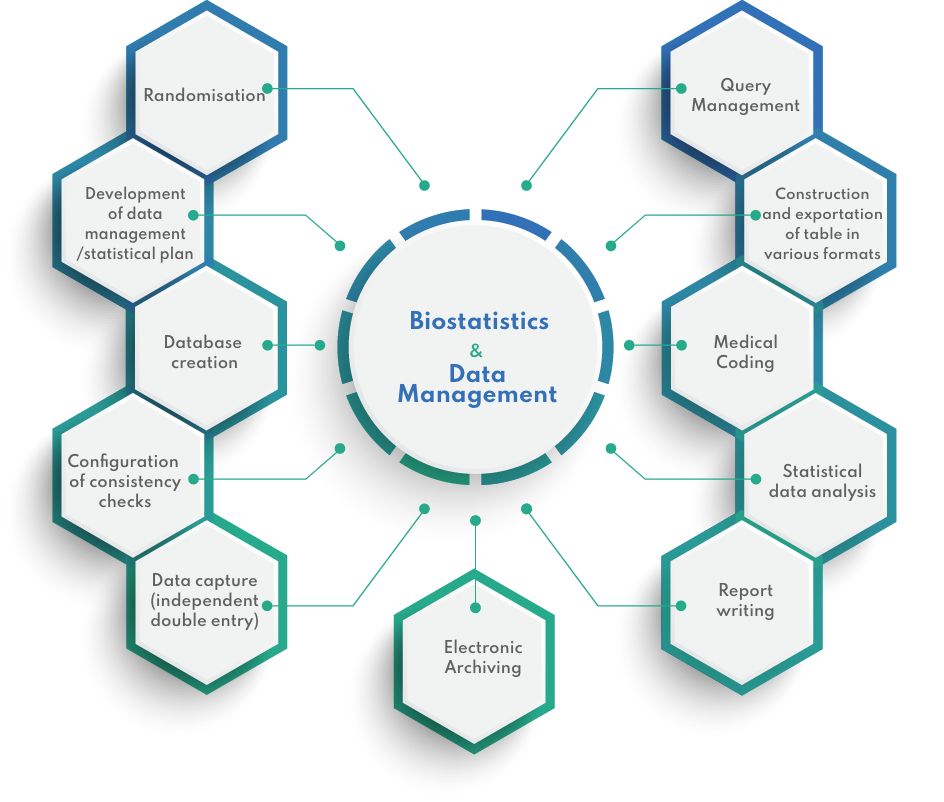
我们的工具

为实现数字化目标,CIDP 现提出以下建议 Datacapt 用于所有化妆品研究,无论其规模和复杂程度如何。
- 符合 FDA 标准和监管准则的工具
- 全面掌控临床研究
- 无论您身在何处,都能进行远程监控
- 实时通报 AE 或纳入情况
电子通用报告格式
通过电子病例报告表模块,我们可以建议赞助商建立和验证电子病例报告表。
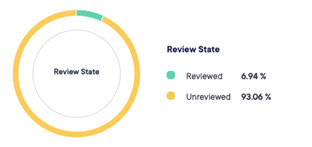
数据可实时采集和审查,并可在试验过程中导出数据。
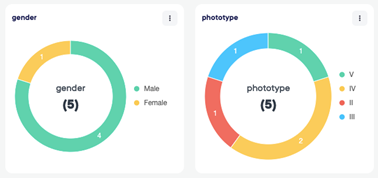
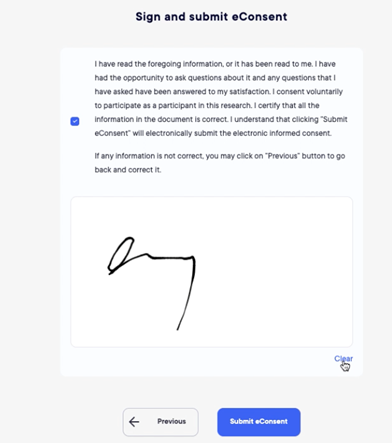
电子同意
通过电子同意模块,受试者现在可以在到现场签字之前阅读完整的研究文件。

电子 CRF 由公司内部使用 ENNOV Clinical 设计,这是一款完全符合 FDA 标准的软件应用程序,用于管理临床试验期间生成的数据(FDA 21 CFR Part 11)。具体工作包括
- 编写数据管理计划(DMP)
- 数据库设计和测试
- 数据输入(单或双输入)
- 医疗编码(MedDRA 和 WHO DD)
- 数据验证和查询管理
- 数据库锁定

我们的统计专业知识范围广泛,从进行简单的统计测试到建立复杂的疗效或安全性变量模型。我们的服务包括
- 进行统计分析
- 撰写统计分析计划 (SAP)
- 样本量的确定
- 随机化
- 进行统计分析
- 表格结果的验证
- 根据 ICH 指南(E9)撰写统计分析报告




