
Fundada en 2004, CIDP (Centre International de Développement Pharmaceutique) es una organización internacional de investigación por contrato (CRO) que lleva a cabo actividades de I+D de alto nivel para las industrias farmacéutica, de dispositivos médicos, nutracéutica y cosmética.
Bioestadística y gestión de datos
GESTIÓN DE DATOS Y BIOESTADÍSTICA
La gestión de datos clínicos es un paso importante y crítico en los ensayos clínicos. En CIDP, nuestras soluciones se adaptan a sus necesidades, sin comprometer la calidad ni los plazos. Podemos ofrecerle una amplia gama de servicios, desde la tradicional doble introducción de datos en hojas de cálculo hasta la captura de datos complejos de ensayos clínicos en completas suites de gestión de datos.
Con más de 16 años de experiencia en una amplia gama de ensayos, nuestro equipo de gestores de datos clínicos, estadísticos colegiados y operadores de introducción de datos está bien equipado para realizar análisis estadísticos que van desde pruebas estadísticas sencillas hasta modelizaciones complejas de variables de eficacia, de acuerdo con los principios estadísticos para ensayos clínicos ICH E9.

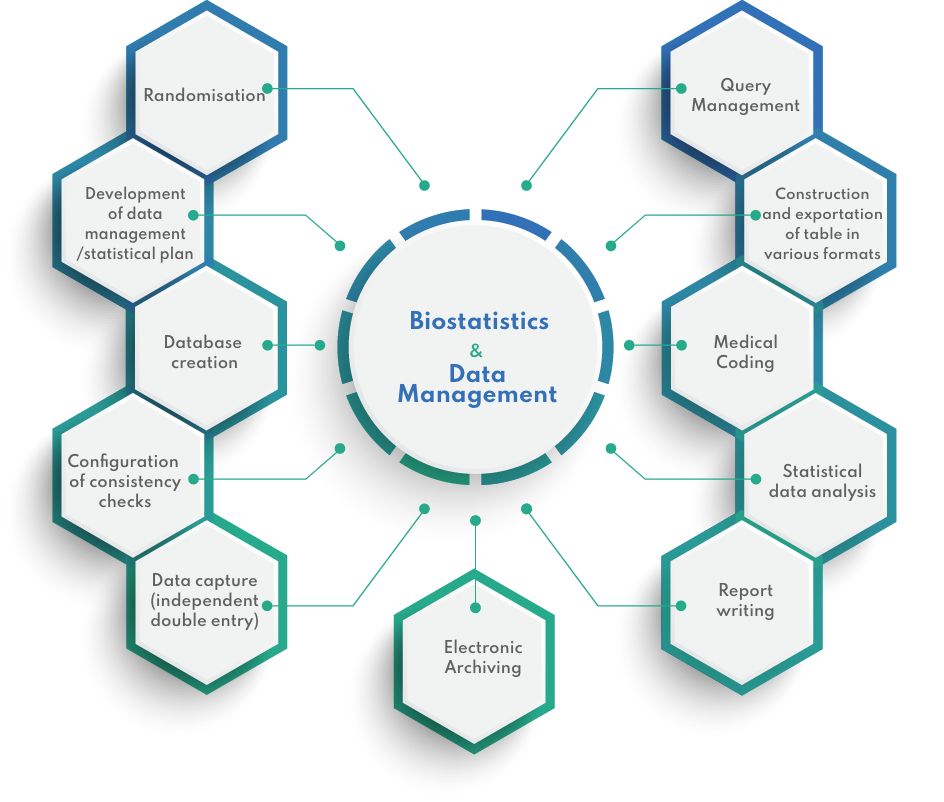
Nuestras herramientas

En línea con su objetivo de digitalización, el CIDP propone ahora Datacapt para todos los estudios cosméticos, independientemente de su tamaño y complejidad.
- Una herramienta que cumple la FDA y las directrices normativas
- Control total de sus estudios clínicos
- Supervisión a distancia, independientemente de su ubicación
- Recibir notificaciones de EA o inclusión en tiempo real
CRF electrónico
El módulo de eCRF nos da la opción de proponer a nuestros patrocinadores que construyan y validen el formulario electrónico de notificación de casos.
Los datos pueden capturarse y revisarse en tiempo real, con posibilidad de exportarlos durante el transcurso del ensayo.
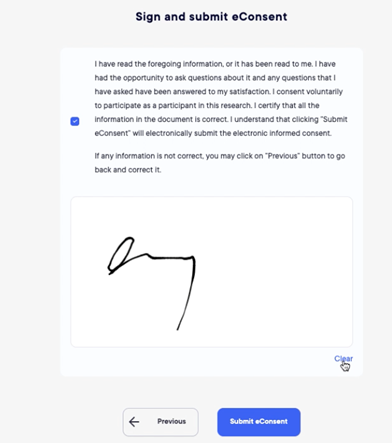
Consentimiento electrónico
El módulo de eConsenting permite ahora a los sujetos leer la documentación completa del estudio antes de acudir al centro para la firma.

Los CRF electrónicos se diseñan internamente utilizando ENNOV Clinical, una aplicación de software totalmente compatible con la FDA para la gestión de los datos generados durante los ensayos clínicos (FDA 21 CFR Parte 11). Las actividades específicas incluyen:
- Redacción del Plan de Gestión de Datos (PGD)
- Diseño y pruebas de bases de datos
- Entrada de datos (simple o doble entrada)
- Codificación médica (MedDRA y DD de la OMS)
- Validación de datos y gestión de consultas
- Bloqueo de la base de datos

Nuestra experiencia estadística abarca desde la realización de pruebas estadísticas sencillas hasta la modelización de variables complejas de eficacia o seguridad. Nuestros servicios incluyen:
- Realización de análisis estadísticos
- Redacción del Plan de Análisis Estadístico (PAE)
- Determinación del tamaño de la muestra
- Aleatorización
- Realización de análisis estadísticos
- Validación de los resultados tabulares
- Redacción del informe de análisis estadístico según las directrices ICH (E9)
Un servicio completo de CRO




