Fundada en 2004, CIDP (Centre International de Développement Pharmaceutique) es una organización internacional de investigación por contrato (CRO) que lleva a cabo actividades de I+D de alto nivel para las industrias farmacéutica, de dispositivos médicos, nutracéutica y cosmética.
CIDP INDIA
Fundada en 2011, CIDP India está situada en el corazón de Nueva Delhi, en Rajender Nagar, muy cerca de varias estaciones de metro, paradas de autobús y estaciones de tren, y a unos 20 minutos del aeropuerto internacional Indira Gandhi. Con un espacio de oficinas que abarca 4850 pies cuadrados, las instalaciones están divididas en dos bloques principales que comprenden áreas de estudio y administrativas.

El CIDP India cuenta con un equipo de 25 personas formado principalmente por:
- Investigador principal y coinvestigadores
- Gestores, monitores y coordinadores de ensayos clínicos
- Equipo de Calidad, Salud, Seguridad y Medio Ambiente (QHSE)
- Responsable de contratación por temas
- Asesores en materia de reglamentación
Además, el CIDP colabora con numerosos investigadores externos, oftalmólogos y pediatras para la realización de estudios.
Voluntarios
Con una población de 31 millones de habitantes en Nueva Delhi, nuestra base de datos interna contiene unos 9000 voluntarios de fototipo III- VI .
Delhi disfruta de 5 estaciones (verano, monzón, otoño, invierno y primavera) y los estudios pueden planificarse durante todo el año sin grandes trastornos.
Patologías cutáneas comunes: Acné, Melasma, Manchas oscuras (PIHP, pecas, lentigos solares), Vitíligo, Psoriasis del cuero cabelludo, Eczema y Seborrea.

Productos en investigación
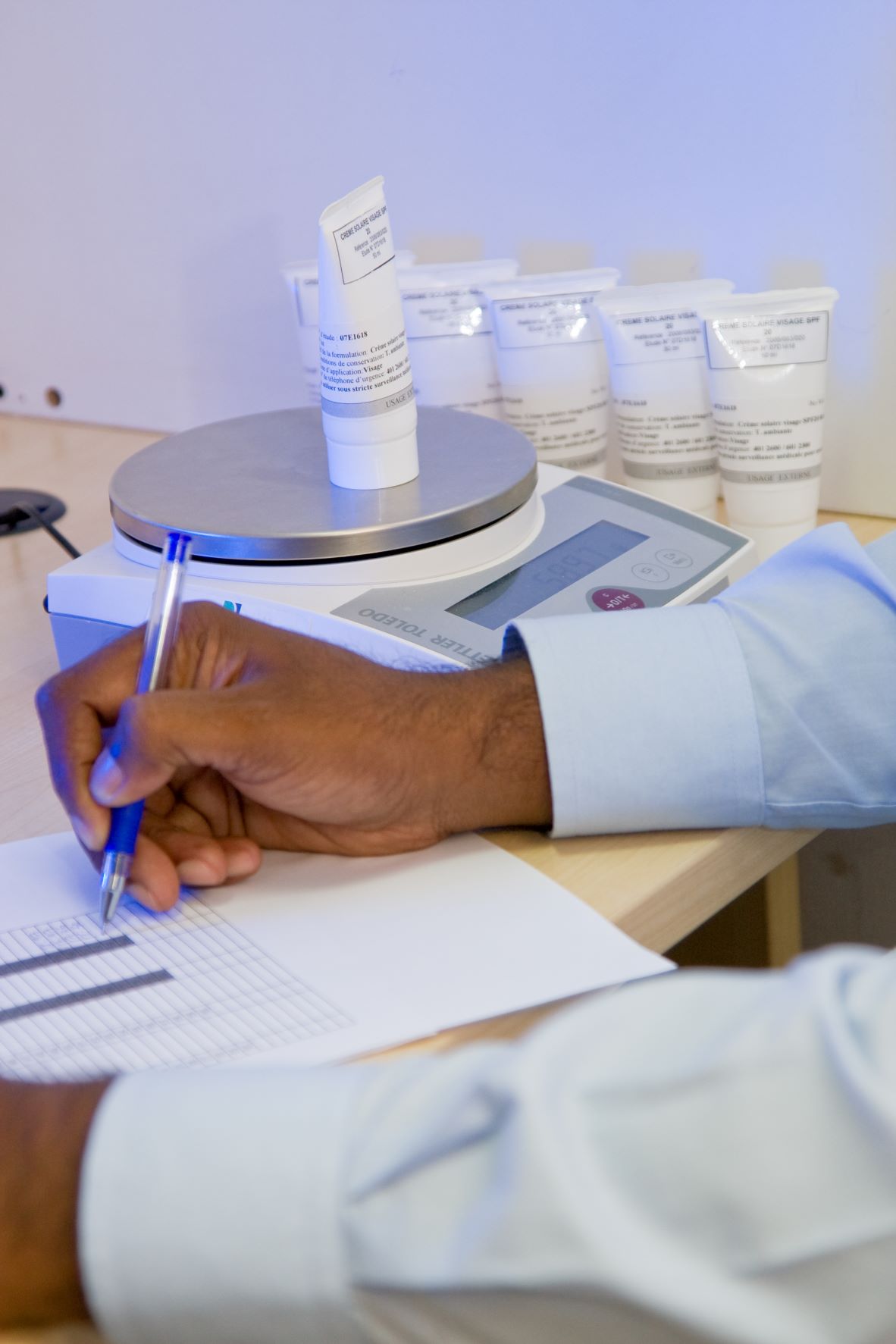
El CIDP recomienda encarecidamente enviar tl producto en investigación a través de su empresa si tiene una sucursal en la India ya que Esto puede facilitar el proceso de recepción del producto en investigación en la India. El envío del producto se inicia normalmente tras de obtener la autorización ética.
El envío de productos en investigación requiere una licencia de importación (productos farmacéuticos) de la DCGI (Controlador General de Medicamentos de India) y un certificado de no objeción de la ADC (para productos cosméticos).
Normativa
Cada estudio clínico realizado en CIDP India está de acuerdo con las normas éticas, ICMR- directrices éticas para la investigación biomédica en participantes humanos, ICH-GCP y las legislaciones locales( Las nuevas normas sobre medicamentos y ensayos clínicos de 2019 ). Puede tardar entre 15 y 30 días para la aprobación de la CE local y 90 días para la aprobación de la DCGI.

COLABORACIÓN
- Bioinnovat Research Services Pvt. Ltd
- Facultad de Medicina Maulana Azad
- Instituto Panindio de Facultades de Medicina (AIIMS)
- Facultad de Medicina Lady Hardinge
- Hospital Sir Ganga Ram
- Hospital Safdarjung
Un servicio completo de CRO

Nuestra galería
Recepción

Sala de espera

Sala de investigadores
Sala de muestras

Champú

India
32-B, Primera planta, Rajendra Nagar, Pusa Road, Nueva Delhi -110005