
Créé en 2004, le CIDP (Centre International de Développement Pharmaceutique) est une CRO (Contract Research Organisation) internationale qui mène des activités de recherche clinique de haut niveau pour les industries pharmaceutiques, les dispositifs médicaux, les nutraceutiques et les cosmétiques.
Biostatistique et gestion des données
GESTION DES DONNÉES ET BIOSTATISTIQUES
La gestion des données cliniques est une étape importante et critique des essais cliniques. Au CIDP, nos solutions sont taillées sur mesure pour répondre à vos besoins, sans compromis sur la qualité et les délais. De la double saisie traditionnelle de données dans des feuilles de calcul à la capture de données d'essais cliniques complexes dans des solutions électroniques, nous pouvons offrir une large gamme de services.
Avec plus de 16 ans d'expérience dans un large éventail d'essais, notre équipe de gestionnaires de données cliniques, de statisticiens agréés et d'opérateurs de saisie de données est bien équipée pour effectuer des analyses statistiques allant de tests statistiques simples à la modélisation complexe de variables d'efficacité, conformément aux principes statistiques de l'ICH E9 pour les essais cliniques.

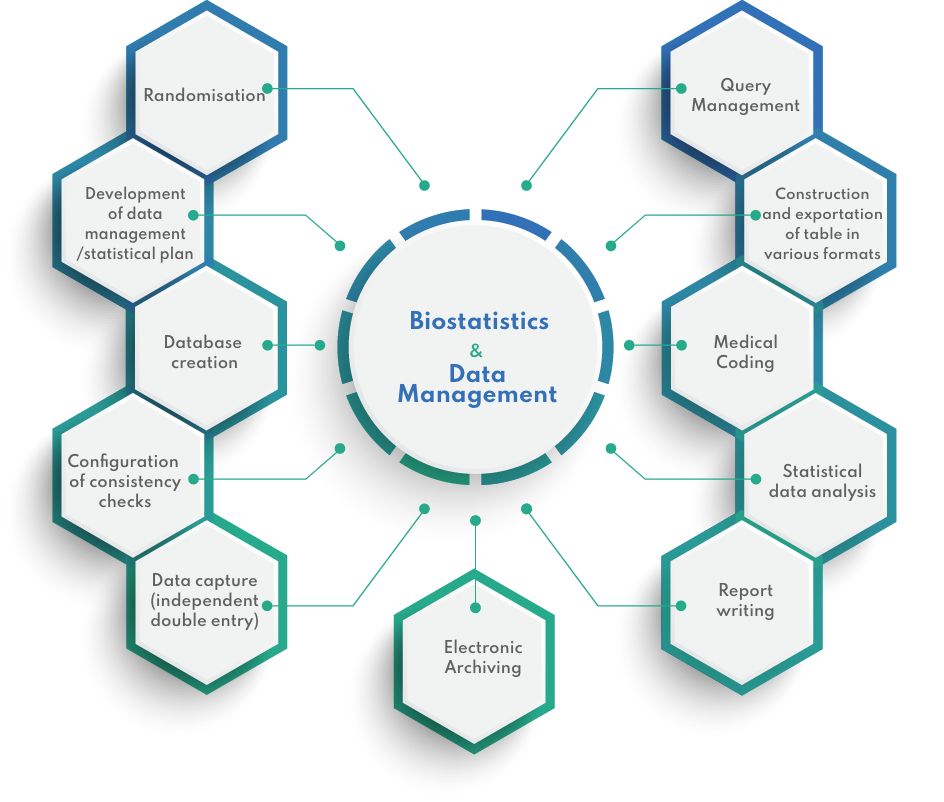
Nos outils

Dans le cadre de son objectif de digitalisation, le CIDP propose désormais Datacapt pour toutes les études cosmétiques, quelles que soient leur taille et leur complexité.
- Un outil conforme à la FDA et aux directives réglementaires
- Un contrôle total sur vos études cliniques
- Supervision à distance, quel que soit l'endroit où vous vous trouvez
- Notification des EI ou de l'inclusion en temps réel
CRF électronique
Le module d'eCRF nous donne la possibilité de proposer à nos sponsors de construire et de valider un formulaire électronique de rapport de cas.
Les données peuvent être saisies et examinées en temps réel, avec la possibilité d'exporter les données au cours de l'essai.
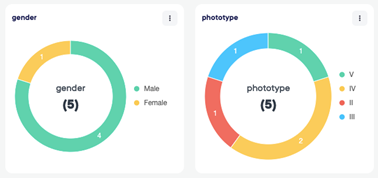
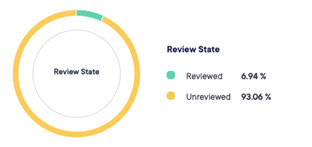
Consentement électronique
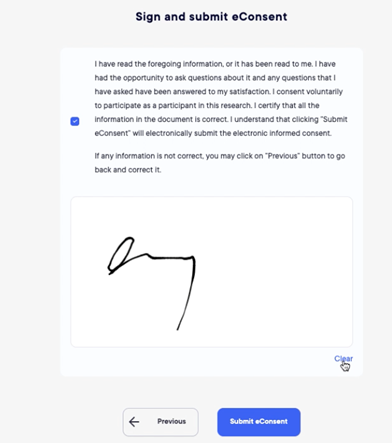
Le module de consentement électronique permet aux sujets de lire l'intégralité de la documentation de l'étude avant de se rendre sur place pour la signature.

Les CRF électroniques sont conçus en interne à l'aide d'ENNOV Clinical, un logiciel entièrement conforme aux normes de la FDA pour la gestion des données générées au cours des essais cliniques (FDA 21 CFR Part 11). Les activités spécifiques comprennent
- Rédaction du plan de gestion des données (PGD)
- Conception et test de bases de données
- Saisie de données (simple ou double)
- Codage médical (MedDRA et WHO DD)
- Validation des données et gestion des requêtes
- Verrouillage de la base de données

Notre expertise statistique va de la réalisation de tests statistiques simples à la modélisation de variables complexes d'efficacité ou de sécurité. Nos services comprennent :
- Conduite de l'analyse statistique
- Rédaction du plan d'analyse statistique (PAS)
- Détermination de la taille de l'échantillon
- Randomisation
- Conduite d'analyses statistiques
- Validation des résultats tabulaires
- Rédaction du rapport d'analyse statistique conformément aux lignes directrices de l'ICH (E9)
Nos services clés




