
Fundado em 2004, o CIDP (Centre International de Développement Pharmaceutique) é uma CRO internacional que realiza atividades de P&D de alto nível para as indústrias farmacêutica, de dispositivos médicos, nutracêutica e cosmética.
Bioestatística e gerenciamento de dados
GERENCIAMENTO DE DADOS E BIOESTATÍSTICA
O gerenciamento de dados clínicos é uma etapa importante e crítica nos estudos clínicos. No CIDP, nossas soluções são feitas sob medida para atender às suas necessidades, sem comprometer a qualidade e os prazos. Desde a tradicional entrada dupla de dados em planilhas até a captura de dados complexos de ensaios clínicos em suítes completas de gerenciamento de dados, podemos oferecer uma ampla gama de serviços.
Com mais de 16 anos de experiência em uma ampla gama de estudos, nossa equipe de gerentes de dados clínicos, estatísticos credenciados e operadores de entrada de dados está bem equipada para realizar análises estatísticas que vão desde testes estatísticos simples até a modelagem complexa de variáveis de eficácia, de acordo com os Princípios Estatísticos para Estudos Clínicos ICH E9.

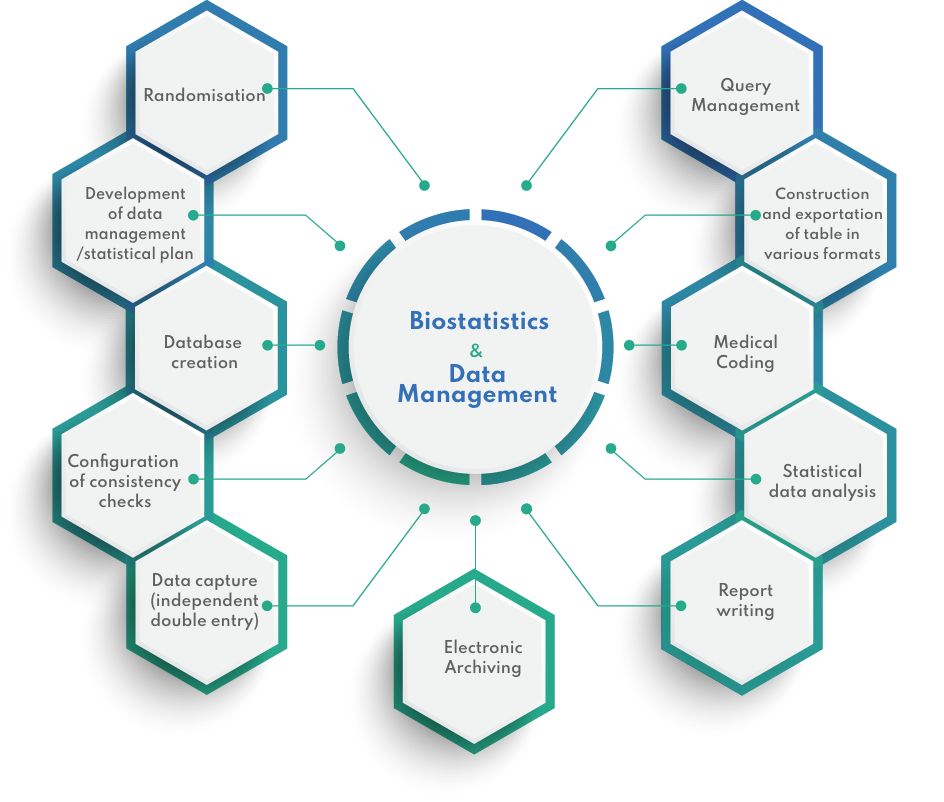
Nossas ferramentas

Em linha com seu objetivo de digitalização, o CIDP agora propõe Datacapt para todos os estudos cosméticos, independentemente de seu tamanho e complexidade.
- Uma ferramenta que está em conformidade com a FDA e atende às diretrizes regulatórias
- Ter controle total sobre seus estudos clínicos
- Realização de monitoramento remoto, independentemente de sua localização
- Ser notificado sobre EAs ou inclusão em tempo real
CRF eletrônico
O módulo do eCRF nos dá a opção de propor aos nossos patrocinadores a criação e a validação do formulário de relato de caso eletrônico.
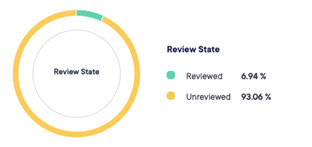
Os dados podem ser capturados e revisados em tempo real, com a possibilidade de exporta-los durante o estudo.
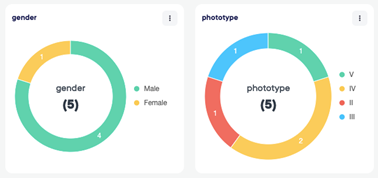
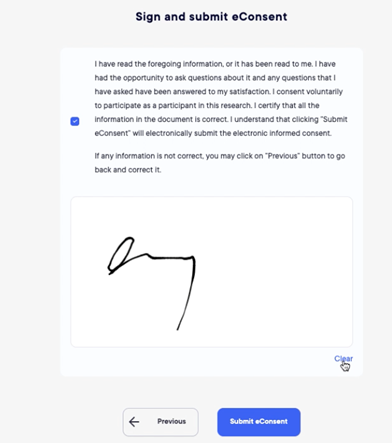
Consentimento eletrônico
O módulo de eConsenting permite que os participantes leiam toda a documentação do estudo antes de comparecer ao local para assinatura.

Os CRFs eletrônicos são projetados internamente usando o ENNOV Clinical, um aplicativo de software totalmente compatível com a FDA para o gerenciamento de dados gerados durante estudos clínicos (FDA 21 CFR Parte 11). As atividades específicas incluem:
- Elaboração do Plano de Gerenciamento de Dados (DMP)
- Projeto e teste de banco de dados
- Entrada de dados (entrada simples ou dupla)
- Codificação médica (MedDRA e WHO DD)
- Validação de dados e gerenciamento de consultas
- Bloqueio de banco de dados

Nosso conhecimento estatístico abrange desde a realização de testes estatísticos simples até modelos de variáveis complexas de eficácia ou segurança. Nossos serviços incluem:
- Condução da análise estatística
- Elaboração do Plano de Análise Estatística (SAP)
- Determinação do tamanho da amostra
- Randomização
- Condução de análises estatísticas
- Validação de resultados tabulares
- Redação do relatório de análise estatística de acordo com as diretrizes do ICH (E9)
Uma CRO de serviço completo




